在我们接触的用户中,有一些孩子存在自闭症、多动等行为问题。今天从营养干预的角度,我们来讨论肠道菌群对这些问题的影响。
行为问题的原因非常复杂,其中遗传因素是最主要的问题。遗传因素在行为问题中非常常见,例如多动症、抽动症等,在孩子的父母或其他亲属小时候可能也存在类似问题。此外,也会受到家庭环境、社会因素和生理发展等因素影响,但是上述因素往往难以改变或改变不易。
然而,还存在一个我们可以改变的影响因素,那就是营养因素。这包括食物方面的因素,如食物过敏和食物不耐受;以及肠道菌群,因为许多维生素和神经因子都是在肠道产生的。此外,蔬菜中常见的维生素,如叶酸,也对肠道菌群起着重要作用。本次讨论主要关注肠道菌群对行为问题的影响因素。
我们经常说,肠道菌群是人体的第二套基因组。因为人体中寄生了大量细菌,这些细菌的数量远超过我们自身细胞的数量。
肠道细菌是人体吸收和排泄大部分营养素和毒素的地方,而肠道细菌群则是肠道最重要的居民。因此,肠道细菌与人体健康、行为和大脑发育有着密不可分的关系。
肠道菌群与肠脑轴之间存在着密切的关系。肠脑轴指的是肠道和大脑之间的双向通信系统,通过神经、内分泌和免疫途径进行交流。
肠道菌群指的是人体肠道中的微生物群落,主要由细菌组成。这些微生物在肠道中执行许多重要的功能,包括消化食物、合成维生素、调节免疫系统等。最近的研究表明,肠道菌群还可以通过产生代谢产物和激活神经传导等方式影响大脑的功能和行为。
具体而言,肠道菌群通过以下几种方式与肠脑轴相互作用:
神经途径:肠道菌群可以通过肠道和大脑之间的神经传导途径相互作用。肠道菌群可以释放一些化合物,如神经递质和短链脂肪酸,这些化合物可以通过神经传导影响大脑的功能和情绪状态。
免疫途径:肠道菌群可以调节肠道免疫系统的功能,从而影响全身性的免疫反应。失衡的肠道菌群可能导致免疫系统异常激活,进而对大脑产生负面影响。
代谢途径:肠道菌群可以代谢食物中的一些化合物,并产生多种代谢产物。这些代谢产物可以通过血液循环进入大脑,并影响神经递质的合成和释放,从而调节大脑的功能和行为。
肠道发育和大脑发育基本上是同步的。当肠道发育逐渐成熟时,大脑发育也达到最完善的状态。而当菌群发育受限时,整个大脑的发育也会受到影响。
目前在儿童行为问题中,多动症和自闭症与肠道菌群的关系非常密切。
首先,肠道菌群产生的一些毒素和神经因子可能对行为产生影响。
其次,肠道菌群是生物屏障的一部分,其失衡可能导致过敏增加,引发过敏性或免疫性脑损伤。
在肠道菌群中,有两类重要的益生菌:双歧杆菌和乳酸杆菌。双歧杆菌作为我们身体最基础的菌种,在干预中起着重要作用。其次是乳酸杆菌,数量虽然较少,但它具有较强的功能和活性。
因此,在儿童行为问题干预中,双歧杆菌和乳酸杆菌发挥着同等重要的作用,不能偏废。
首先,对于自闭症和多动症等问题,肠道菌群多样性不佳是主要问题之一。
其次,一些常见的有害菌,如艰难梭菌和脱硫弧菌,在正常孩子的肠道中也可能存在。但如果这些有害菌数量过多,它们产生的有害物质可能导致孩子注意力不集中、行为无法控制等问题。
怎么样对抗有害菌呢?是不是要杀菌?现在功能医学,包括很多临床医生说有害菌就要杀,但没有一个抗生素只杀有害菌。实际上它不管你是有害菌,还是有益菌,统统都会杀掉。
这个菌是肠道本身的一部分,只要环境没有改变,它还会一直生长。所以杀菌是不可取的,我们要用大量的益生菌来干预占位。
假如说双歧杆菌给的多,乳杆菌给的多,把整个营养争夺掉,艰难梭菌自然没有营养了,慢慢就消失了,并不是一定要杀菌。
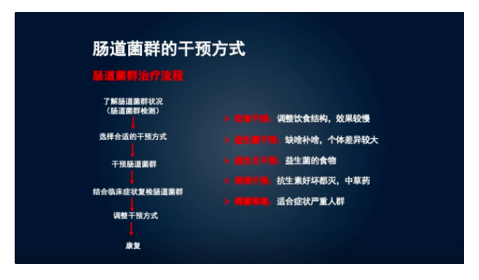
益生菌的干预需要个性化定制。益生菌在不同人群中的定植是不一样的,肠道均衡性、多样性是不一样的,有害菌是不一样的,一定要根据孩子肠道的一个状况来针对性补充。
个性化定制的干预的前提是检测。现在的技术非常先进,通过宏基因技术(如16S、18S),可以测量孩子肠道的多样性、有害菌益生菌的数量。这些数据将帮助我们了解孩子肠道菌群的现状,并根据具体情况进行营养干预。
在个性化的干预中,除了通过饮食补充益生菌外,还可以考虑使用益生元。益生元是指能够促进益生菌生长和活性的物质,通常是一些特定的膳食纤维。益生元可以作为益生菌的“食物”,帮助它们在肠道中生长繁殖。
此外,饮食结构也需要调整。增加蔬菜、水果和全谷类食物的摄入量,提供丰富的维生素、矿物质和纤维素,有助于改善肠道环境,促进益生菌的生长。
总之,肠道菌群与行为问题有着密切的关系。通过调整肠道菌群的营养干预,我们可以改善肠脑轴的功能,减少行为问题的发生。个性化的干预方案,包括增加益生菌和益生元的摄入量,以及调整饮食结构,可以帮助改善孩子的行为问题。
1.Adams JB, Johansen LJ, Powell LD, Quig D, Rubin RA. Gastrointestinal flora and gastrointestinal status in children with autism-comparisons to typical children and correlation with autism severity. BMC Gastroenterology. 2011;11(1):22.
2.Kang DW, Park JG, Ilhan ZE, et al. Reduced incidence of Prevotella and other fermenters in intestinal microflora of autistic children. PLOS ONE. 2013;8(7):e68322.
3.De Angelis M, Piccolo M, Vannini L, et al. Fecal microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specified. PLOS ONE. 2013;8(10):e76993.
**本文部分图文素材转载于欧蒙未一互联网医院公众号(gh_a7385779ba6a)网络,转载目的在于传递更多更全面的信息。如涉及作品内容、版权和其它问题,请在30日内联系本站客服微信,我们将在第一时间删除内容!